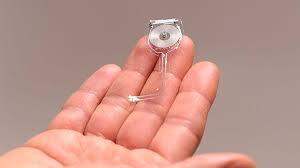
Ahora, investigadores de la Escuela de Medicina de la Universidad de Washington en San Luis y la Universidad de Northwestern, en Estados Unidos, han desarrollado un dispositivo implantable y biodegradable que suministra pulsos regulares de electricidad a los nervios periféricos dañados en ratas, ayudando a los animales a regenerar los nervios en sus patas y recuperar su función nerviosa y la fuerza muscular más rápida. El dispositivo dura aproximadamente dos semanas antes de ser completamente absorbido por el cuerpo.
Para la mayoría de las personas con lesiones en los nervios periféricos, los médicos sugieren analgésicos como la ‘Aspirina’ y la terapia física. Los casos graves pueden requerir cirugía y la práctica estándar es administrar algo de estimulación eléctrica a los nervios lesionados durante la cirugía para ayudar a la recuperación.
“Sabemos que la estimulación eléctrica durante la cirugía ayuda, pero una vez que finaliza la cirugía, se cierra la ventana para intervenir –dice el coautor principal Wilson “Zack” Ray, profesor asociado de Neurocirugía, Ingeniería Biomédica y Ortopedia y Cirugía en la Universidad de Washington, Estados Unidos–. Con este dispositivo, hemos demostrado que la estimulación eléctrica administrada de forma programada puede mejorar aún más la recuperación del nervio”.
A diferencia de las neuronas en el cerebro y la médula espinal, los nervios periféricos que atraviesan los brazos, las piernas y el torso pueden regenerarse después de una lesión. La estimulación eléctrica desencadena la liberación de proteínas que promueven el crecimiento, potenciando las capacidades naturales de las células nerviosas y ayudándolas a crecer de forma más rápida y completa.
Pero hasta ahora, los médicos han carecido de medios para proporcionar continuamente ese impulso adicional. El coautor principal John Rogers, de Northwestern, y sus colegas diseñaron y desarrollaron un dispositivo que envuelve un nervio lesionado y transmite pulsos eléctricos durante días antes de que el dispositivo se degrade inofensivamente en el cuerpo. El dispositivo, que se describe en un artículo publicado este lunes en ‘Nature Medicine’, se alimenta de forma inalámbrica mediante un transmisor fuera del cuerpo que actúa de manera muy parecida a la base de carga de un teléfono celular.
Hacia la medicina bioelectrónica
“Estas plataformas representan los primeros ejemplos de una ‘medicina bioelectrónica’: sistemas diseñados que brindan una función terapéutica activa en un formato de dosis programable y luego desaparecen de forma natural en el cuerpo, sin dejar rastro –dice Rogers–. En el caso del que informamos aquí, construimos dispositivos electrónicos bioabsorbibles que soportan una función única relevante para la recuperación del daño a un nervio periférico, a través de la estimulación eléctrica en determinados momentos durante el proceso de curación”.
Los investigadores estudiaron ratas con nervios ciáticos lesionados, los cuales envían señales hacia arriba y abajo de las piernas y controlan los músculos isquiotibiales y los músculos de la parte inferior de las piernas y los pies. Utilizaron el dispositivo para proporcionar una hora al día de estimulación eléctrica a las ratas durante uno, tres o seis días, o ninguna estimulación eléctrica en absoluto, y luego monitorizaron su recuperación durante las siguientes diezsemanas.
Cualquier estimulación eléctrica fue mejor que nada para ayudar a las ratas a recuperar la masa muscular y la fuerza muscular. Además, cuantos más días de estimulación eléctrica recibieron las ratas, más rápida y exhaustivamente recuperaron la señal nerviosa y la fuerza muscular.
“Antes de hacer este estudio, no estábamos seguros de que una estimulación más prolongada marcaría una diferencia, y ahora que sabemos que sí podemos empezar a tratar de encontrar el marco de tiempo ideal para maximizar la recuperación –apunta Ray–. Si hubiésemos administrado estimulación eléctrica durante 12 días en lugar de seis, ¿habría habido más beneficios terapéuticos? Tal vez. Estamos investigando eso ahora”.
Al variar la composición y el grosor de los materiales en el dispositivo, Rogers y sus colegas pueden controlar la cantidad precisa de días que dura antes de desintegrarse. Ahora, estos científicos están trabajando en la creación de nuevas versiones que puedan proporcionar pulsos eléctricos durante semanas antes de degradarse.
“Realmente no hay opciones terapéuticas para algunos de estos pacientes con lesión nerviosa –señala Ray–. Esta tampoco es una opción terapéutica, ya que no se ha probado en personas. Pero estoy entusiasmada porque es un nuevo enfoque para tratar la lesión de nervios periféricos, y podría ofrecer una solución donde realmente no hay ninguna hoy en el ámbito clínico”.
Fuente: infosalus.com