Un nuevo estudio publicado en la revista científica Nature revela factores moleculares que determinan el destino de células madre cardíacas específicas y describe los mecanismos que producen la interrupción del desarrollo cardíaco. Este estudio, cuyos resultados sonfruto de una estrecha colaboración entre investigadores del Luxembourg Centre for Systems Biomedicine (LCSB) de la Universidad de Luxemburgo, el Gladstone Institutes de California y el CIC bioGUNE (España), ofrece un nuevo marco de trabajo para la investigación de los defectos cardíacos congénitos. Mientras que el equipo estadounidense aportó el conocimiento experimental y la validación in vivo, el grupo de LCSB y CIC bioGUNE utilizó su experiencia para la modelización computacional de redes complejas.
La formación de un órgano completo como el corazón requiere que los diferentes tipos de células se agrupen y se organicen de una manera específica. Si se interrumpe la maduración y migración de estas células, pueden producirse malformaciones cardíacas congénitas, que son los defectos congénitos más comunes. Sin embargo, hasta ahora, los procesos que gobiernan cómo cada tipo de célula se mueve hacia el lugar correcto en el momento adecuado han sido, en gran medida, un misterio.
Para estudiar estos procesos, los investigadores primero tuvieron que discernir el papel de decenas de miles de células durante la formación del corazón, como paso esencial para determinar cómo las mutaciones genéticas pueden causar defectos de nacimiento. “Con la secuenciación del genoma, nos resulta más fácil encontrar variantes genéticas que creemos que están contribuyendo a una enfermedad”, dijo el Dr. Deepak Srivastava, Presidente e Investigador Principal de Gladstone. “El gran desafío es averiguar el tipo específico de célula en el que esta variante funciona y cómo esas células son impactadas.” Srivastava y su equipo han conseguido elaborar un catálogo con todos los genes que están activos en las diferentes fases del desarrollo del corazón, identificando las células en las que se encuentran.
Tras identificar los numerosos tipos de células involucradas en el desarrollo del corazón, los investigadores experimentales querían saber cómo se generan. Para ello, formaron equipo con los biólogos computacionales, especialistas en descubrir los factores moleculares que impulsan el desarrollo de diferentes tipos de células.
“Nuestro grupo tiene una larga historia en el desarrollo de modelos computacionales para entender la conversión de células. Contamos con los conocimientos necesarios para estudiar redes completas de factores moleculares que controlan la identidad celular”, explicó el Prof. Antonio del Sol, responsable del grupo de Biología Computacional de la LCSB e investigador Ikerbasque en el Centro de Investigación Cooperativa CIC bioGUNE. “Cuando nos sumamos al proyecto, aplicamos nuestro método para predecir – sin ningún tipo de conocimiento previo – qué factores gobiernan el destino de las diferentes células cardíacas”.
Antonio del Sol se ha incorporado recientemente a CIC bioGUNE como investigador Ikerbasque, dondelidera el laboratorio de Biología Computacional. Es, asimismo, profesor de Bioinformática de la Universidad de Luxemburgo y jefe del grupo de BiologíaComputacional en la LCSB. En los últimos años, su laboratorio se ha especializado en el área de sistemas de biología de células madre. El objetivo principal de la investigación de Antonio del Sol es desarrollar enfoques matemáticos y computacionales para abordar cuestiones clave en los campos de investigación con células madre, medicina regenerativa y modelización de la enfermedad.
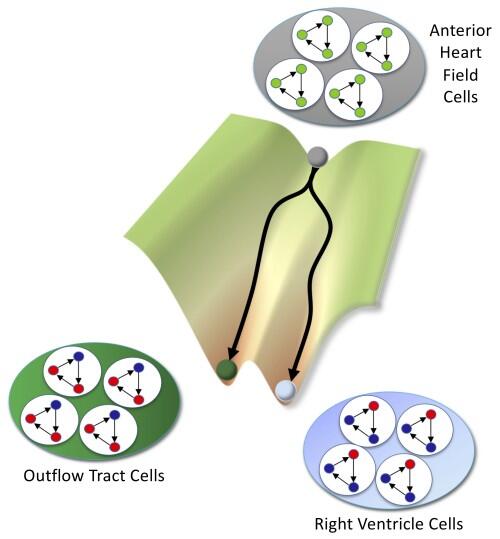
El análisis computacional predijo con éxito los factores moleculares implicados en la generación de tipos específicos de células en el corazón. Identificó especialmente a un actor principal, denominado Hand2, como clave para la especificación de las células del tracto de salida, la estructura por la que surgen los principales vasos sanguíneos salientes del corazón.
Mientras que, en condiciones de laboratorio, en los ratones que carecían de Hand2 no se logró formar el ventrículo derecho, que bombea sangre a los pulmones, la nueva predicción sugirió que Hand2 no es necesario para las células a las que se les instruye que se conviertan en células del ventrículo derecho. En cambio, el modelo computacional predijo que Hand2 es crítico en la formación de las células del tracto de salida.
Este resultado inesperado dio lugar a nuevos experimentos para resolver la discrepancia entre el análisis computacional y las observaciones previas in vivo. La predicción resultó ser correcta, lo cual resalta la precisión del modelo computacional.
Estos resultados han revelado los mecanismos por los cuales la interrupción del destino de unas pocas células durante el desarrollo produce defectos en la formación del corazón. Además de ofrecer un nuevo marco para la investigación de defectoscardíacos congénitos, podrían abrir vías para la aplicación de prtocolos de terapia celular.
“Hemos podido demostrar que, con nuestro modelo, es posible identificar los factores que son esenciales para la diferenciación de células cardíacas específicas”, explicó Antonio Del Sol. “Más recientemente, hemos desarrollado un método computacional más general para la conversión celular y estamos probando su aplicabilidad. Hemos hecho nuevas predicciones sobre una manera eficiente de convertir las células cardíacas del ventrículo derecho en células del ventrículo izquierdo y viceversa. Nuestros compañeros en EEUU están trabajando en la validación experimental”. (Fuente: CIC bioGUNE)